27/01/2026
En el vasto universo de la química y sus aplicaciones prácticas, comprender y manipular la concentración de las soluciones es una habilidad fundamental. Desde la preparación de medicamentos vitales en un hospital hasta el análisis de la calidad del agua que bebemos, la precisión en estas mediciones es crucial. Este artículo te guiará a través de los conceptos esenciales de la concentración, explicándote cómo trabajar con Partes por Millón (ppm) y cómo realizar diluciones y concentraciones de manera efectiva.
La concentración de una solución es una medida de la cantidad de soluto disuelto en una cantidad dada de solvente o de solución. Existen diversas formas de expresar esta relación, pero dos de las más comunes y de gran relevancia son el porcentaje y las Partes por Millón (ppm). Mientras que el porcentaje es útil para concentraciones relativamente altas, las ppm son indispensables cuando hablamos de trazas o cantidades muy pequeñas de una sustancia en una mezcla.
¿Qué son las Partes por Millón (ppm)?
Las Partes por Millón, comúnmente abreviadas como ppm, son una unidad de medida utilizada para expresar concentraciones muy bajas de un soluto en una solución. Piensa en ello como una forma de decir 'cuántas partes de una sustancia hay por cada millón de partes de la solución total'. Es particularmente útil en campos como la química ambiental, la toxicología, la calidad del agua y el aire, donde los contaminantes o componentes activos pueden estar presentes en cantidades minúsculas, pero aún así ser significativos.
Formalmente, las ppm se definen como la masa del soluto dividida por la masa de la solución, multiplicada por un millón (10^6). Aunque esta es la definición más rigurosa, en soluciones acuosas diluidas (donde la densidad de la solución es aproximadamente 1 g/mL), a menudo se simplifica a miligramos de soluto por litro de solución (mg/L) o microgramos de soluto por mililitro de solución (µg/mL). Para gases, las ppm pueden referirse a partes por volumen, como mililitros por metro cúbico.
Es importante recordar que las ppm son una relación sin unidades si se expresan como masa/masa (g/g * 10^6), pero se les asigna unidades como mg/L para mayor claridad en contextos específicos. La clave es que representan una cantidad extremadamente pequeña en relación con el todo, haciendo que la escala de 'partes por millón' sea la más adecuada para su cuantificación.
Cómo Convertir de Porcentaje a ppm: Una Conversión Sencilla
A menudo, te encontrarás con concentraciones expresadas en porcentaje (%) y necesitarás convertirlas a ppm, o viceversa. Afortunadamente, esta conversión es bastante directa y se basa en la definición de ambas unidades.
Un porcentaje (%) significa 'partes por cien'. Por ejemplo, una solución al 1% (m/m) significa que hay 1 gramo de soluto por cada 100 gramos de solución. Si queremos expresar esto en partes por millón, necesitamos saber cuántas partes de soluto hay por cada millón de partes de solución.
La relación es la siguiente: 1% equivale a 10,000 ppm.
Por lo tanto, para convertir una concentración dada en porcentaje (%) a Partes por Millón (ppm), simplemente debes multiplicar el valor del porcentaje por 10,000.

ppm = % de concentración * 10,000
Veamos un ejemplo práctico:
Si tienes una solución de cloruro de sodio al 0.05% (m/m), ¿cuál es su concentración en ppm?
ppm = 0.05 * 10,000 = 500 ppm
Esto significa que por cada millón de partes de la solución, hay 500 partes de cloruro de sodio. Esta conversión es extremadamente útil para comparar concentraciones de diferentes escalas y para reportar resultados en unidades estandarizadas para análisis de trazas.
Dilución y Concentración de Soluciones: Conceptos Clave
En el laboratorio, en la industria o en la medicina, es muy común la necesidad de cambiar la concentración de una solución. Esto se logra mediante dos procesos opuestos: la dilución y la concentración.
La dilución es el proceso de añadir más solvente a una solución, lo que resulta en una disminución de la concentración del soluto. Imagina que tienes un café muy cargado y le añades agua; lo estás diluyendo y su sabor se vuelve menos intenso. La cantidad total de soluto permanece constante, solo que se distribuye en un volumen mayor.
Por otro lado, la concentración es el proceso de eliminar el solvente de una solución, lo que provoca un aumento en la concentración del soluto. Esto generalmente se logra mediante la evaporación o ebullición del solvente, asumiendo que el soluto no se ve afectado por el calor. Si dejas secar el café, el agua se evapora y lo que queda es una pasta mucho más concentrada. Al igual que en la dilución, la cantidad de soluto no cambia, pero ahora está presente en un volumen de solvente más pequeño.
La clave para ambos procesos es que la cantidad de soluto disuelto permanece inalterada. Este principio es la base para los cálculos de dilución y concentración.
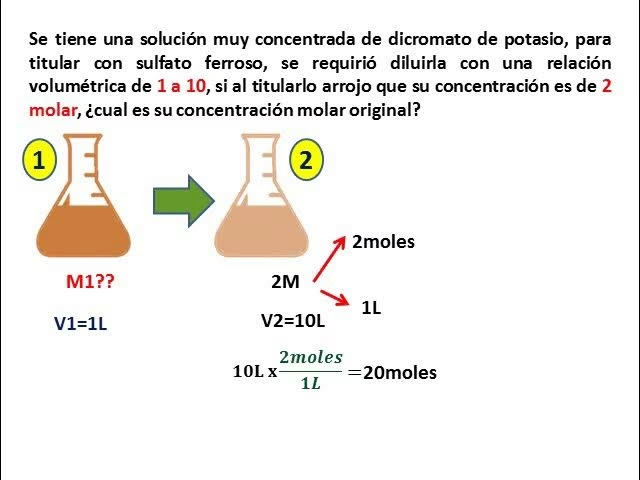
La Ecuación de Dilución: M1V1 = M2V2
Dado que la cantidad de soluto no cambia durante la dilución o concentración, podemos utilizar una ecuación simple pero poderosa para calcular los nuevos volúmenes o concentraciones. Esta ecuación se deriva de la definición de molaridad (moles de soluto / volumen de solución), pero es aplicable a cualquier unidad de concentración (como porcentaje o ppm) siempre que se mantengan las mismas unidades a ambos lados de la ecuación.
La ecuación es la siguiente:
M1V1 = M2V2
Donde:
- M1 es la concentración inicial de la solución.
- V1 es el volumen inicial de la solución.
- M2 es la concentración final deseada de la solución.
- V2 es el volumen final de la solución después de la dilución o concentración.
Es crucial que las unidades de volumen (V) sean consistentes (por ejemplo, ambos en mL o ambos en L) y que las unidades de concentración (M) también lo sean (por ejemplo, ambos en M, % o ppm). ¡La consistencia es la clave!
Veamos algunos ejemplos para ilustrar su uso:
Ejemplo 1: Cálculo de la Concentración Final después de una Dilución
Si 25.0 mL de una solución 2.19 M se diluyen a un volumen final de 72.8 mL, ¿cuál es la concentración final?
- M1 = 2.19 M
- V1 = 25.0 mL
- V2 = 72.8 mL
- M2 = ?
Usando la ecuación M1V1 = M2V2:
(2.19 M) * (25.0 mL) = M2 * (72.8 mL)
Despejando M2:
M2 = (2.19 M * 25.0 mL) / 72.8 mL
M2 = 54.75 / 72.8 M
M2 ≈ 0.752 M
La concentración de la solución ha disminuido, como era de esperar en una dilución. Para lograr esto, se añadieron 72.8 mL - 25.0 mL = 47.8 mL de solvente.
Ejemplo 2: Cálculo del Volumen Final para una Concentración Deseada
Una solución de KBr 0.885 M con un volumen inicial de 76.5 mL se diluye con agua hasta que su concentración es de 0.500 M. ¿Cuál es el nuevo volumen de la solución?
- M1 = 0.885 M
- V1 = 76.5 mL
- M2 = 0.500 M
- V2 = ?
Usando la ecuación M1V1 = M2V2:
(0.885 M) * (76.5 mL) = (0.500 M) * V2
Despejando V2:
V2 = (0.885 M * 76.5 mL) / 0.500 M
V2 = 67.7025 / 0.500 mL
V2 ≈ 135.4 mL
El nuevo volumen de la solución es de aproximadamente 135.4 mL.

Ejemplo 3: Concentración de Soluciones por Evaporación
Si 665 mL de una solución 0.875 M de KBr se hierven suavemente para concentrar el soluto a 1.45 M, ¿cuál será su volumen final?
- M1 = 0.875 M
- V1 = 665 mL
- M2 = 1.45 M
- V2 = ?
Aplicando la ecuación M1V1 = M2V2:
(0.875 M) * (665 mL) = (1.45 M) * V2
Despejando V2:
V2 = (0.875 M * 665 mL) / 1.45 M
V2 = 581.875 / 1.45 mL
V2 ≈ 401 mL
El volumen final de la solución será de aproximadamente 401 mL. Se ha eliminado solvente para aumentar la concentración.
Aplicaciones Prácticas y la Importancia de la Precisión Química
La capacidad de calcular y manipular la concentración de soluciones no es solo un ejercicio académico; tiene aplicaciones vitales en múltiples campos:
- Medicina y Farmacia: Los profesionales de la salud constantemente preparan soluciones intravenosas (IV), dosifican medicamentos y ajustan concentraciones para tratamientos específicos. Un error en el cálculo puede tener consecuencias graves, haciendo de la precisión una responsabilidad crítica. Por ejemplo, preparar una solución de KCl al 0.5% a partir de una solución madre al 10% para un paciente requiere una dilución cuidadosa y exacta.
- Análisis Ambiental: Para monitorear la calidad del agua o del aire, es esencial medir la presencia de contaminantes en ppm o incluso ppb (partes por billón). Los cálculos de dilución son necesarios para preparar estándares de calibración a partir de soluciones madre de alta concentración.
- Laboratorios de Investigación e Industria: En cualquier laboratorio químico, la preparación de reactivos con concentraciones exactas es fundamental para la reproducibilidad de los experimentos y la calidad de los productos químicos. Esto incluye la síntesis de nuevos materiales, el control de calidad de productos y la investigación científica.
- Agricultura: La preparación de fertilizantes líquidos o pesticidas a la concentración correcta para evitar daños a los cultivos o al medio ambiente.
La importancia de estos cálculos radica en la seguridad y la efectividad. Entender cómo y cuándo aplicar estas fórmulas y principios es una habilidad invaluable.
| Característica | Dilución | Concentración | Partes por Millón (ppm) |
|---|---|---|---|
| Proceso Principal | Adición de solvente | Eliminación de solvente | Medida de concentración |
| Efecto en la Concentración | Disminuye | Aumenta | Expresa trazas (muy bajas) |
| Cantidad de Soluto | Permanece constante | Permanece constante | Cantidad específica de soluto |
| Ecuación Aplicable | M1V1 = M2V2 | M1V1 = M2V2 | (Masa soluto / Masa solución) * 10^6 |
| Uso Típico | Preparar soluciones menos concentradas | Aumentar la fuerza de una solución | Análisis de contaminantes, trazas |
Preguntas Frecuentes (FAQ)
¿Cuál es la diferencia entre dilución y concentración?
La dilución es el proceso de disminuir la concentración de una solución añadiendo más solvente, mientras que la concentración es el proceso de aumentar la concentración de una solución eliminando solvente. En ambos casos, la cantidad de soluto permanece constante.
¿Qué cantidad permanece constante cuando se diluye una solución?
La cantidad de soluto (en moles o masa) es la que permanece constante durante un proceso de dilución o concentración. Lo que cambia es el volumen del solvente y, por ende, la concentración de la solución.
¿Cuándo es más apropiado usar ppm en lugar de porcentaje?
Es más apropiado usar ppm cuando la concentración del soluto es muy baja, típicamente para concentraciones menores al 1%. Las ppm permiten expresar estas cantidades minúsculas de manera más manejable y significativa, por ejemplo, en la detección de contaminantes en el agua o el aire.
¿La ecuación M1V1 = M2V2 solo aplica para molaridad?
No, la ecuación M1V1 = M2V2 puede aplicarse a cualquier unidad de concentración (como porcentaje, ppm, normalidad, etc.) siempre y cuando las unidades de concentración (M1 y M2) y las unidades de volumen (V1 y V2) sean consistentes a ambos lados de la ecuación.
Dominar los cálculos de concentración, ya sea en ppm o mediante diluciones, es una habilidad esencial en el ámbito científico y profesional. La capacidad de preparar soluciones con la concentración adecuada garantiza la seguridad, la precisión en los resultados y la eficacia en cualquier aplicación. Con los principios y ejemplos proporcionados en este artículo, esperamos que te sientas más seguro para enfrentar cualquier desafío relacionado con las soluciones y sus concentraciones.
Si quieres conocer otros artículos parecidos a Concentración de Soluciones: De PPM a Dilución puedes visitar la categoría Química.

